2025年2月,国内批准首款羟基磷灰石(CaHA)医美注射产品——上海摩漾生物科技有限公司(下简称:摩漾)的Aphranel®、幽抚兰®(商品名)。紧接着3月,梅尔茨北美公司(Merz North America Inc.,下简称Merz)的注射用羟基磷酸钙微球面部填充剂Radiesse®(瑞德喜)获批。
值得注意的是,虽然Radiesse®(瑞德喜)在2025年才在国内获批,但是该产品早在2006年就已经获得FDA认证。
为此,我们整理了目前FDA官网已公开的Radiesse®(瑞德喜)相关资料,并结合已公开的摩漾注射用羟基磷酸钙微球面部填充剂的注册技术审评报告进行对比分析,供大家参考。
从FDA官网记录来看,Radiesse®(瑞德喜)于2006年通过PMA路径获批(PMA编号:P050052),适应症为:适用于皮下植入,用于矫正中度至重度面部皱纹和褶皱,例如鼻唇沟;
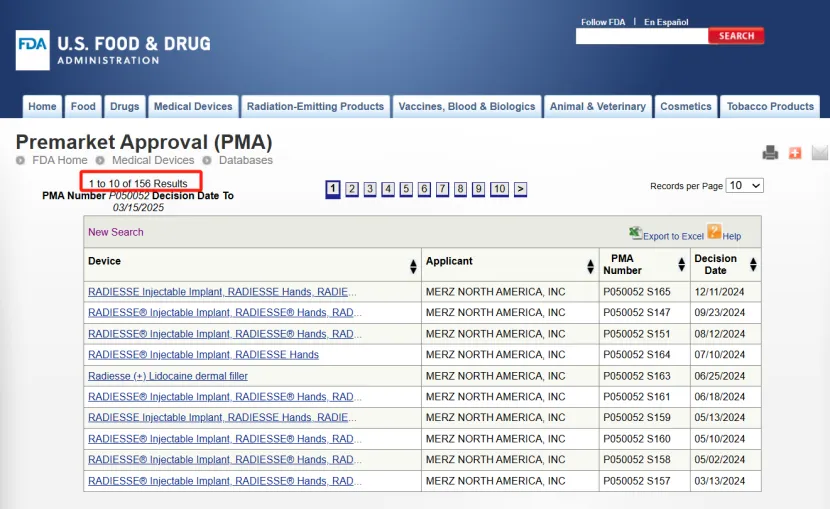
2021年,RADIESSE®(+)再次扩适应证(PMA编号:P050052/S129),适用于深层注射(皮下和/或骨膜上)用于软组织增强,以改善 21 岁以上成年人的中度至重度下颌线轮廓缺失。
02
产品综合比
对为了方便您快速了解相关差异,我们根据现有公开材料对部分要点进行了综合分析比对。如您想了解详细内容,可以添加小助手获取本期内容资料包。
· 适应证对比

·临床前研究对比

·临床前研究对比

03
小结与建议
摩漾与 Radiesse®(瑞德喜)两款产品因选择的对照品不同,直接对比临床结果可能意义有限。但深入分析相关报告后,仍可洞察 FDA 与 NMPA 在监管要求上的差异,而理解并攻克这些差异,正是企业顺利通过 FDA 认证的关键所在。
基于此,我们总结了以下建议,以期为企业提供有益的参考与启发:
若计划申请 FDA 认证,临床前相关项目需提前规划,如生物相容性测试、动物试验等。特别是对于一些特殊设计的产品,如含有新型成分或采用新注射技术的产品,更需要提前进行相关研究,以满足 FDA 对产品安全性和有效性的严格要求。
FDA 对于产品风险管理的要求更为严格及精细化。例如,在 2021 年的RADIESSE®(+)报告中提到,治疗后,需持续监测下颌线填充的血管栓塞风险,包括通过 X 光 / CT 验证无移位等。此外,对于其他潜在风险,如注射部位反应、长期安全性等,也应进行全面监测和评估。
· 完善整体证据链:
FDA 强调整体证据链,包括长期数据、种族多样性、器械操作细节等。若计划出海,企业需系统性地补足 FDA 的“全证据链”要求,尤其是长期随访、种族数据及器械操作风险验证等方面。例如,进行多中心、大样本量的临床试验,涵盖不同种族、年龄、性别的受试者,以提供更全面的数据支持。
FDA 对临床试验设计的要求较高,强调随机化、对照组设置、样本量计算等的科学性和合理性。企业应确保临床试验设计符合 FDA 的相关指导原则,以提高试验结果的可信度和可接受性。
高风险类产品申请FDA认证是一项专业复杂的系统性项目,丽和康国际团队拥有多款高风险、创新型产品成功申报FDA认证的项目经验。可以为您提供包括但不限于以下服务:
✓ 产品分类界定
✓ FDA认证:510(k)/PMA/De Novo/HDE/BTD
✓ QSR820/MDSAP体系认证辅导服务
✓ 可用性测试服务
✓ FDA模拟工厂审核
……
如您需要本期推文相关报告原件资料包,或有产品计划申请FDA认证,可扫描下方二维码联系丽和康小助手!

