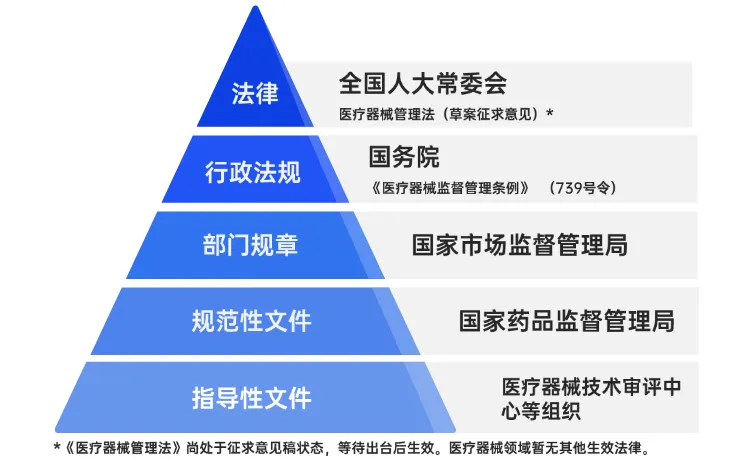
中国医疗器械法规框架是一个多层次、全方位的法律规范体系,从国务院行政法规的宏观指导,到部门规章和规范性文件的具体实施,再到指导性文件的技术支持,每一层级的法规都在医疗器械的研制、生产、经营、使用以及监督管理中发挥着重要作用。
目前构成我国医疗器械监管法规体系依次是法律、行政法规、部门规章、规范性文件和指导性文件。五个层级法规的效力自上而下,下位法不得抵触上位法,但可以在上位法的规定中作出具体规定。
(注:宪法作为国家的根本大法,规定拥有最高法律效力,但其并未直接涉及医疗器械的监管,因此,本文未将其纳入医疗器械法律法规体系框架。)
法律制度是一个国家或地区的所有法律原则和规则的总称,经过拥有国家立法权的全国人民代表大会和全国人民代表大会常务委员会通过后,由国家主席签署主席令予以公布。
2024年8月29日,国家药监局综合司公开征求《中华人民共和国医疗器械管理法(草案征求意见稿)》意见。当前,医疗器械的法律法规框架中暂无已生效的法律。
行政法规由国务院制定,并由国务院总理签署国务院令公布。
《医疗器械监督管理条例》(国令第739号)*其适用范围为“第二条 在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,适用本条例。”其明确了医疗器械的分类管理、注册与备案、生产质量管理、经营与使用、不良事件监测与召回等基本要求,是当前医疗器械法规体系的最高层级。
(*根据2017年5月4日《国务院关于修改〈医疗器械监督管理条例〉的决定》进行了第一次修订;2020年12月21日,国务院第119次常务会议修订通过;根据2024年12月6日《国务院关于修改和废止部分行政法规的决定》进行了第二次修订。)
医疗器械法律框架中的部门规章是由国家市场监督管理总局制定的规范性文件。
按照医疗器械的全生命周期,这些部门规章可以归类为注册与备案、生产、经营与使用、上市后监管、监督检查五类,常见部门规章:
1)注册与备案
– 《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号) (2021-08-31)
– 《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号) (2021-08-31)
2)生产
– 《医疗器械生产监督管理办法》(国家市场监督管理总局令第53号) (2022-03-22)
3)经营与使用
– 《医疗器械经营监督管理办法》(国家市场监督管理总局令第54号) (2022-03-22)
– 《医疗器械网络销售监督管理办法》(国家食品药品监督管理总局令第38号) (2017-12-22)
– 《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18号) (2015-12-21)
4)不良事件的处理与医疗器械的召回(上市后监管)
– 《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号) (2018-08-31)
– 《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号) (2017-02-08)
5)监督检查
– 《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号) (2015-06-29)
......
4 规范性文件
规范性文件指除法律、法规、规章以外的行政机关及法律、法规授权的具有管理公共事务职能的组织(此处主要指由国家药品监督管理局(NMPA)发布的法规文件)在职权范围内依法制定的在本行政区域或其管理范围内具有普遍约束力,在一定期限内反复适用的文件。
全生命周期规范性文件列举(部分):
1)注册与备案
– 国家药监局关于实施医疗器械注册有关事项行政文书电子化的公告(2024年第68号) (2024-05-31)
– 国家药监局关于发布《医疗器械产品注册项目立卷审查要求》等文件的通告(2022年第40号)(2022-09-01)
– 国家药监局关于发布《医疗器械注册自检管理规定》的公告(2021年第 126号)(2021-10-22)
2)生产
– 国家药监局关于进一步加强医疗器械注册人委托生产监督管理的公告(2024年第38号) (2024-04-03)
– 国家药监局关于发布禁止委托生产医疗器械目录的通告(2022年第17号) (2022-03-24)
3)经营与使用
– 国家药监局关于印发医疗器械经营质量管理规范现场检查指导原则的通知(国药监械管〔2024〕20号)(2024-07-30)
– 国家药监局关于公布《免于经营备案的第二类医疗器械产品目录》的公告(2021 年第 86号)(2021-06-30)
4)不良事件的处理与医疗器械的召回(上市后监管)
– 国家药监局综合司关于印发医疗器械注册人备案人开展不良事件监测工作检查要点的通知(药监综械管〔2021〕43 号)(2021-04-09)
– 国家药监局关于发布医疗器械定期风险评价报告撰写规范的通告(2020 年第 46 号)(2020-07-02)
5)监督检查
– 国家药监局关于实施《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》有关事项的通告(2022年第18号) (2022-03-23)
– 国家药监局关于印发医疗器械质量抽查检验管理办法的通知(国药监械管〔2020〕9号) (2020-03-13)
……
由监管机构(医疗药监局医疗器械技术审评中心-CMDE)发布的指导原则及其相关通知。
部分指导原则列举:
– 《医疗器械产品技术要求编写指导原则》(2022年第8号)
– 《医疗器械临床评价技术指导原则》(2021年第73号)
– 《医疗器械可用性工程注册审查指导原则》(2024年第13号)
......

1)法规、部门规章、规范性文件。
查询路径:
NMPA官网(https://www.nmpa.gov.cn)-法规文件

2)国家标准/行业标准
NMPA年度更新《医疗器械标准目录》,汇总现行有效医疗器械国家标准和行业标准,涵盖了医疗器械的各个领域用于规范医疗器械研制、生产、经营到使用的技术规范文件。
1)法规、部门规章、规范性文件
查询路径:
CMDE官网(https://www.cmde.org.cn/)-法规文件-法规/部门规章/规范性文件

2)指导性文件
查询路径:CMDE官网-审评科学-指导原则

各地行业会定期汇总国家政策法规和地方性法规文件,并按照发布法规文件的效力层级进行归类。
部分协会列举:
1)苏州市医疗器械行业协会-国家政策法规模块(http://www.szamdi.cn/?about/43)

2)深圳市医疗器械行业协会-政策法规模块 (https://www.samd.org.cn/home/newsList?typeId=440&navFlag=ncs5)